某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
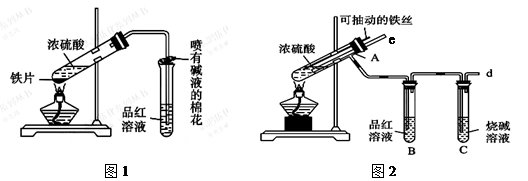
(1)能说明有SO2气体产生的实验现象是 。
(2)图2中导气管e的主要作用为 。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是 。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+; Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液
B.稀硫酸
C.KSCN溶液
D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、
| 。 |
(1)B中品红溶液褪色 (1分)
(2)停止加热时,能防止倒吸或平衡压强(凡合理答案均可)(2分)
(3)2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4(2分)
(4)便于控制反应的发生和停止 (2分)
(5)
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色的明显变化,则说明Ⅱ成立。(1分) (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。(1分) |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性KMnO4溶液 。(1分) | 如果滴加酸性KMnO4溶液后溶液的紫红色褪色,则说明溶液中含有Fe2+,说明Ⅲ成立;如果滴加酸性KMnO4溶液后溶液紫红色不褪,则说明溶液中没有Fe2+,说明Ⅰ成立。5Fe2+ + MnO4- +8H+ = 5Fe3+ + Mn2+ +4H2O 。(2分) |
题目分析:(1)二氧化硫的特性是使品红溶液褪色,因此能说明有SO2气体产生的实验现象是:B中品红溶液褪色。
(2)停止加热时,装有铁和浓硫酸的试管中压强减小,有这样一根导管能防止倒吸或平衡压强。
(3)2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4(2分)
(4)想让反应开始,把铁丝推一下让其接触浓硫酸,想让反应停止时,将铁丝拉离浓硫酸,这样便于控制反应的发生和停止
(5)铁离子与硫氰化钾反应可以生成血红色的溶液,用此来检验三价铁离子,二价铁离子的检验是得用其还原性。亚铁离子被高锰酸钾氧化,然后再利用硫氰化钾来进行确定。
