实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
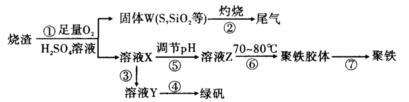
(1)过程①中,FeS和O2、H2SO4反应的化学方程式为 。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的 吸收。
a.浓H2SO4 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是
(4)过程④的实验操作是
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为 。
(1)4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S(2分)
(2)c(2分) (3)铁(2分)
(4)蒸发(浓缩)、(冷却)结晶、过滤、洗涤(4分,浓缩、冷却不写可以不扣分)
(5)促进Fe3+的水解(2分)
(6)31.11%(3分)
题目分析:
(1)根据固体W的成分中存在S,推出FeS和O2、H2SO4发生氧化还原反应,FeS做还原剂,O2作氧化剂,产物有Fe2(SO4)3、S、H2O。
(2)污染物是SO2,用碱液吸收。
(3)溶液X中的铁是Fe3+,绿矾中的铁为Fe2+,故应加入Fe粉,将Fe3+还原为Fe2+。
(4)对能形成结晶水合物的盐溶液不能采取直接蒸干的办法制取晶体。
(5)升高温度,促进Fe3+的水解。 (6)③得到的沉淀是BaSO4,n(BaSO4) = =0.015mol,根据聚铁主要成分为[Fe(OH)SO4] n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84g,铁元素的质量分数:ω(Fe)=(0.84g/2.700g)×100%=31.11%。
=0.015mol,根据聚铁主要成分为[Fe(OH)SO4] n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84g,铁元素的质量分数:ω(Fe)=(0.84g/2.700g)×100%=31.11%。
