有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: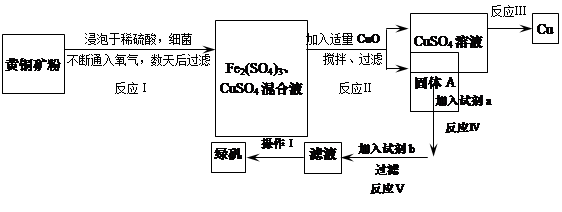
回答下列问题:
(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(1)加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因 。
(2)写出能实现反应Ⅲ的化学方程式 。
(3)试剂b为 。
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、 、 。
(5)反应Ⅰ的化学方程式 。
(1)Fe3+在溶液中存在水解平衡,即Fe3++ 3H2O Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
(2)2CuSO4+2 H2O 2Cu+O2+2H2SO4.或Fe+CuSO4=Cu+FeSO4
2Cu+O2+2H2SO4.或Fe+CuSO4=Cu+FeSO4
(3) Fe;(4)结晶、过滤(5)4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O
题目分析:(1)Fe3+在溶液中存在水解平衡,即Fe3++ 3H2O Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
(2)电解硫酸铜溶液,化学方程式为:2CuSO4+2 H2O 2Cu+O2↑+2H2SO4.或Fe+CuSO4=Cu+FeSO4
2Cu+O2↑+2H2SO4.或Fe+CuSO4=Cu+FeSO4
(3)这一问应从工艺流程图的结构入手,通过(1)的分析,已经知道固体A为氢氧化铁,加入试剂a后得到的溶液通过反应v加入b,滤液中的溶质能转化为FeSO4,根据物质的转化原理可知b为Fe。
(4)获得绿矾晶体时先蒸发浓缩,因为硫酸铁的溶解度随温度的升高而增大,所以降温溶解度减小,会析出晶体,最后过滤即可.
(5)反应Ⅰ中的反应物是CuFeS2、O2、H2SO4三种物质,生成物是硫酸铁、硫酸铜和水,根据奇偶法配平,所以方程式是:4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;
