氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。
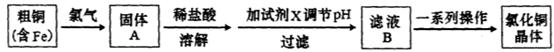
(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
A.NaOH
B.NH3.H2O
C.CuO
D.Cu(OH)2E. CuSO4(3)滤液B经一系列操作可得氯化铜晶体,操作的程序依次为_________ 、_________、 过滤、自然干燥。
(4)实验室采用如下图所示装置,可使粗铜与Cl2反应转化为固体A(部分加热仪器和夹持装置已略去)。
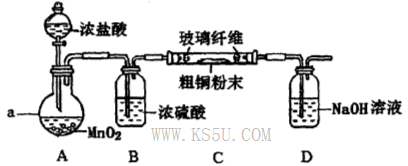
①该装置中仪器a的名称是____,其中发生反应的离子方程式是____________。
②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为是否必要?____________(填“是”或“否”)。
③该装置存在一定的安全隐患,消除该安全隐患的措施是_______________________。
(1)抑制Cu2+、Fe3+等离子发生水解反应 (2)c d (3)蒸发浓缩、冷却结晶
(4)① 圆底烧瓶 MnO2 + 4H++2Cl- Mn2++ Cl2↑ + 2H2O
Mn2++ Cl2↑ + 2H2O
② 否 ③ 在装置C和D之间连接一个防倒吸装置
题目分析:(1)粗铜中含有Cu、Fe,与氯气反应时此时CuCl2、FeCl3,由于二者都是强酸弱碱盐,容易发生水解反应产生Cu(OH)2、Fe(OH)3。为了抑制Cu2+、Fe3+等离子发生水解反应通常用稀盐酸来溶解。
(2)加试剂X用于调节pH以除去杂质,,但不能引入新的杂质离子。根据题目给定的物质,可选用CuO、Cu(OH)2。选项为CD
(3)将除去Fe(OH)3沉淀的含有CuCl2滤液经一系列操作可得氯化铜晶体。CuCl2是强酸弱碱盐,水解产生Cu(OH)2和HCl。盐酸有挥发性,容易挥发逸出。得到的固体是Cu(OH)2。由于它的溶解度受温度的影响变化较大,所以可采用的操作的程序依次为蒸发浓缩、冷却结晶、过滤、自然干燥。(4)实验室制取Cl2是在蒸馏烧瓶中用浓盐酸与二氧化锰共热的方法制取的。反应的滤渣方程式为:MnO2 + 4H++2Cl- Mn2++ Cl2↑ + 2H2O。②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为没有必要。因为Cu与HCl不会发生反应,只有Cl2发生反应。③由于Cl2容易与NaOH发生反应,导致导气管中的压强减小,这时烧杯中的溶液容易倒吸至加热装置,故该装置存在一定的安全隐患,消除该安全隐患的措施是在装置C和D之间连接一个防倒吸装置。
Mn2++ Cl2↑ + 2H2O。②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为没有必要。因为Cu与HCl不会发生反应,只有Cl2发生反应。③由于Cl2容易与NaOH发生反应,导致导气管中的压强减小,这时烧杯中的溶液容易倒吸至加热装置,故该装置存在一定的安全隐患,消除该安全隐患的措施是在装置C和D之间连接一个防倒吸装置。
