铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
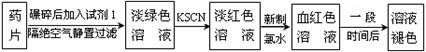
(1)试剂1是 ,加入新制氯水后溶液中发生的离子反应方程式是: , ;
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 ;
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
(1)稀盐酸(或稀硫酸溶液);2Fe2++Cl2=2Fe3++2Cl- ;
Fe3++SCN-=[Fe(SCN)]2+ (或Fe3++3SCN-=[Fe(SCN) 3]);
(2)少量的Fe2+被空气中的氧气氧化;
(3)
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量褪色后溶液,加入KSCN溶液 | 如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 |
| 或 | 取少量褪色后溶液,加入FeCl3溶液 | 如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的 |
题目分析:(1)加入稀盐酸(或稀硫酸溶液)可以使药片充分溶解;氯水中存在氯气分子有强氧化性,发生的反应有:2Fe2++Cl2=2Fe3++2Cl- ;Fe3++SCN-=[Fe(SCN)]2+ (或Fe3++3SCN-=[Fe(SCN) 3]);
(2)少量的Fe2+被空气中的氧气氧化成了三价铁离子故可以产生了血红色现象;
(3)
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量褪色后溶液,加入KSCN溶液 | 如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 |
| 或 | 取少量褪色后溶液,加入FeCl3溶液 | 如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的 |
