铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+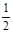 O2(g)
O2(g)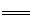 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
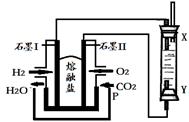
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
(1)2Fe3+ + Cu 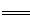 2Fe2+ + Cu2+ (2分)
2Fe2+ + Cu2+ (2分)
(2)-11 kJ·mol-1 (2分)
(3)11.2 g (2分)
(4)①H2 - 2e-+ CO32- CO2+H2O(2分)
CO2+H2O(2分)
②B C (2分)
③白色沉淀迅速变成灰绿色,最终变成红褐色(2分)
4Fe (OH)2+O2+2H2O=4Fe (OH)3 (2分)
题目分析:(1)氯化铁与铜反应生成氯化亚铁与氯化铁,离子方程式为2Fe3+ + Cu  2Fe2+ + Cu2+ ;
2Fe2+ + Cu2+ ;
(2)a、Fe(s)+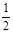 O2(g)═FeO(s)△H=-272 kJ·mol-1
O2(g)═FeO(s)△H=-272 kJ·mol-1
b、C(s)+O2(g)═CO2(g)△H=-393.5 kJ·mol-1
c、2C(s)+O2(g)═2CO(g)△H=-22l kJ·mol-1
依据盖斯定律b-c÷2-a得到:FeO(s)+CO(g) Fe(s)+CO2(g)△H=-1lkJ·mol-1;
Fe(s)+CO2(g)△H=-1lkJ·mol-1;
(3)氢气的物质的量为 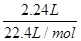 =0.1mol,
=0.1mol,
Fe ~ 2HCl ~ H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为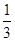 ×(0.16L×5mol·L-1-0.2mol)=0.2mol,
×(0.16L×5mol·L-1-0.2mol)=0.2mol,
Fe ~ 2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g·mol-1=11.2g,
(4)①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2 - 2e-+ CO32- CO2+H2O;
CO2+H2O;
②电解法制备Fe (OH)2时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其他材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe (OH)2沉淀。
③因为在空气中Fe (OH)2容易发生以下反应:4Fe (OH)2+O2+2H2O=4Fe (OH)3(红褐色),所以沉淀中若有Fe (OH)2生成,暴露在空气中白色沉淀迅速变成灰绿色,最终变成红褐色。

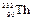 经过6次α衰变和4次β衰变后,成为稳定的原子核
经过6次α衰变和4次β衰变后,成为稳定的原子核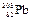
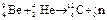
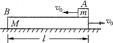
 A(可视为质点),m<M。现以地面为参考系,给A和B以大小相等,方向相反的初速度,使A开始向左运动,B开始向右运动,但最后A刚好没有滑离B板。
A(可视为质点),m<M。现以地面为参考系,给A和B以大小相等,方向相反的初速度,使A开始向左运动,B开始向右运动,但最后A刚好没有滑离B板。