某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1
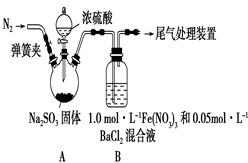
请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 (3)BaSO4 (4) ①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(可分两步写SO2+2Fe3++2H2O=2Fe2++SO42-+4H+、SO42-+Ba2+=BaSO4↓) Fe2+ ②c
题目分析::(l)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原性;(4)假设一 两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应,故答案为:SO2和Fe3+、酸性条件下NO3-都反应;①按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol•L-1NaNO3和0.2mol•L-1盐酸等体积混合的溶液代替,故选c.
