粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质。工业上以粗氧化锌生产硫酸锌晶体(ZnSO4·7H2O)的工艺流程如下图所示:

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
请回答下列问题:
(1)操作③的名称是 ;
(2)加入适量锌粉的作用为 ;
(3)加入30%H2O2反应的离子方程式是 ;
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
(共14分)
(1)蒸发浓缩、冷却结晶、过滤干燥(每个1分,共3分)。
(2)使溶液中的Fe3+转化为Fe2+(2分);除去Cu2+(2分)
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (3分)
(4)c3(H+)/c(Fe3+) (2分); 防止生成Zn(OH)2(2分)
题目分析:ZnO(CuO、Fe3O4、SiO2)在反应1中SiO2不与H2SO4,过滤(操作①)后得到含Fe3+、Zn2+、Fe2+、H+、SO42-溶液,加入适量锌粉2Fe3++Zn= 2Fe2+ +Zn2+、Cu2++ Zn= Cu +Zn2+,过滤(操作②)后Zn2+、Fe2+、SO42-溶液,加入30%H2O2使Fe2+转化为Fe3+,加入适量Ca(OH)2调节溶液pH,使Fe3+沉淀,可得Zn SO4溶液。
从ZnSO4溶液得到硫酸锌晶体(ZnSO4·7H2O)应经过蒸发浓缩、冷却结晶、过滤干燥。
锌粉可以发生2Fe3++Zn= 2Fe2+ +Zn2+、Cu2++ Zn= Cu +Zn2+的反应。
结合题中信息2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。
由Fe3+ +3H2O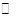 Fe (OH)3+3H+ K= c3(H+)/c(Fe3+);当Ca(OH)2过量使溶液呈碱性时Zn2+会完全生成Zn(OH)2沉淀。
Fe (OH)3+3H+ K= c3(H+)/c(Fe3+);当Ca(OH)2过量使溶液呈碱性时Zn2+会完全生成Zn(OH)2沉淀。
