现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
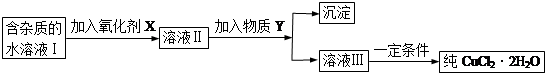

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
(1)C (2)B (3) 2Fe3+ +3Cu(OH)2 = 2Fe(OH)3+3Cu2+ (4)将Fe2+ 氧化为Fe3+,再除去(5)不能;应在氯化氢气氛中浓缩后冷却结晶
题目分析:(1)四种都是强氧化剂,但其他三种加入后会有杂质出现,无法得到纯CuCl2·2H2O,故选C;(2)所加物质为可与氯化铁发生反应生成沉淀,而B不与氯化铁反应;(3)因为Ksp(Fe(OH)3)<Ksp( Cu(OH)2)所以加入Cu(OH)2后生成Fe(OH)3沉淀。(4)Fe3+性质更为稳定,沉淀物更多;(5)不能;应在氯化氢气氛中浓缩后冷却结晶。
