某同学对FeCl3的氧化性以及FeSO4的热稳定性进行如下探究:
(1)查阅资料FeSO4高温分解,反应方程式为: 2FeSO4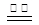 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。
①用双线桥标出高温分解FeSO4制备Fe2O3反应中电子转移的方向和数目 。
②为收集SO3并验证SO2,应将气体依次通过浸没在 中的U型管、洗气瓶中的 和NaOH溶液。
(2)实验探究Fe3+的氧化性:向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色。
①浅绿色溶液中一定存在的离子有H+、Cl-和 ,可能存在的微粒有 (填写序号)。
A.Fe3+ B.Fe2+ C.SO42- D.H2SO3
②为确认可能存在的微粒,应选择的试剂是 (填写序号)。
A.稀硫酸 B.NaOH溶液 C.KSCN溶液 D.品红溶液
① (2分)
(2分)
② 冰水混合物、品红溶液或其他正确答案(各2分)。
(2)①BC(2分), AD(2分)(选对一个得1分,错选0分)
②CD(2分)(选对一个得1分,错选0分)
题目分析:(1)FeSO4高温分解气体为SO2和SO3,收集SO2需先分离出SO3,根据SO3溶沸点高常温下为液体,采用冰水冷却即可得到SO3固体和纯净的SO2气体;检验SO2一般用品红试剂;(2)溶液由黄色变为浅绿色,说明Fe3+与SO2气体反应生成Fe2+和SO4,还可能有未与Fe3+反应的SO2与水反应生成H2SO3,还可能有少量为未反应完的Fe3+,检验这两种微粒分别用品红溶液和KSCN溶液。
