某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ. 解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需 (填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有 (填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:① ;② 。
Ⅱ. 解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式: ,
(2)从实验Ⅱ可得出的结论是 。
Ⅲ. 解决问题3
设计如下装置(夹持装置未画出):
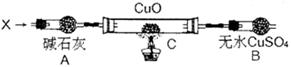
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到0.28 g单质气体Y。
(1)X气体的摩尔质量是 。
(2)C中发生反应的化学方程式为 。
Ⅰ(1)NaOH溶液(1分 )
(2)250mL容量瓶(1分)
(3)①用CuSO4溶液与NaOH溶液反应制Cu(OH)2(1分) ②Cu(OH)2分别与稀硫酸、稀NaOH溶液反应(1分)
Ⅱ(1)Cu2O+2H+=Cu2++Cu↓+H2O(2分)
(2)高温下+1价Cu比+2价Cu稳定,溶液中+2价Cu比+1价Cu稳定(2分)
Ⅲ(1)32 g·mol-1(2分)
(2)2CuO+N2H4 = 2Cu+N2+2H2O(2分)
题目分析:Ⅰ(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验需要的药品是:制取氢氧化铜的硫酸铜和氢氧化钠,验证试验用到硫酸和氢氧化钠,所以需要硫酸铜和氢氧化钠以及硫酸溶液。(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶,容量瓶的规格根据所配置的溶液来确定,故答案为:250mL容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应,所以实验步骤第一步是:用CuSO4溶液和NaOH溶液制Cu(OH)2;第二步是:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应,故答案为:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应;Ⅱ、(1)氧化亚铜与稀硫酸(或盐酸)反应生成金属单质铜和二价铜离子的盐溶液,反应实质是:Cu2O+2H+=Cu+Cu2++H2O,故答案为:Cu2O+2H+=Cu+Cu2++H2O;(2)根据溶液中的离子反应Cu2O+2H+=Cu+Cu2++H2O 可以知道在溶液中Cu2+的稳定性强于Cu+,再根据Cu+的外围电子排布式为3d10,外围电子排布中全充满状态和半充满状态均比较稳定Cu+的外围电子排布为3d10,全充满状态,,故比较稳定;Ⅲ、(1)金属铜不能和稀硫酸反应,氧化亚铜能和稀硫酸反应,生成硫酸铜蓝色溶液,故答案为:将红色物质置于稀硫酸中,溶液不变蓝,则证明为铜;(2)消耗0.01mol X,测得B装置增重0.36g,即生成0.02mol的水,并收集到单质气体Y 0.28g即氮气0.01mol,根据原子守恒可以确定气态氢化物X中含有4个氢原子和2个氮原子,X的化学式为N2H4,摩尔质量为32 g·mol-1。和氧化铜反应的化学方程式为:2CuO+N2H4=2Cu+N2+2H2O,故答案为:2CuO+N2H4=2Cu+N2+2H2O。
