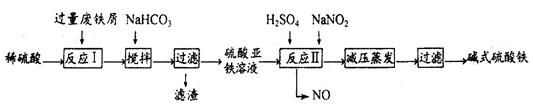
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
(1)Fe2+、Al3+(1分,有错不得分)
(2)Al3+(1分);加快反应速率(或使反应物充分接触,意思相近均给分)(1分)
(3)Fe2++NO2-+2H+=Fe3++NO↑+H2O(2分);氧化剂(1分);2mol(1分)
(4)2[Fe(OH)]2++2H2O [Fe2(OH)4]2++2H+(2分)
[Fe2(OH)4]2++2H+(2分)
题目分析:(1)稀硫酸与铁、氧化铝、氧化铁反应的生成物分别是硫酸亚铁和氢气、硫酸铝和水、硫酸铁和水。由于铁是过量的,所以生成的硫酸铁继续与铁反应生成硫酸亚铁,因此反应I溶液中存在的金属阳离子有Fe2+、Al3+。
(2)由于溶液中只有Fe2+、Al3+两种金属阳离子,而氢氧化铝开始沉淀时的pH值大于氢氧化亚铁开始沉淀时的pH值,所以加入NaHCO3的目的是调节pH,使溶液中的Al3+沉淀;由于搅拌时可以增大反应物的接触面积,从而加快反应速率。
(3)反应II中有NO生成,这说明反应中亚硝酸是氧化剂,将亚铁离子氧化生成了铁离子,反应的离子方程式为Fe2++NO2-+2H+=Fe3++NO↑+H2O;由于要将亚铁离子氧化为铁离子,所以O2与NaNO2在反应中均作为氧化剂;标准状况下11.2L氧气的物质的量是11.2L÷22.4L/mol=0.5mol,氧气在反应中得到4个电子,所以0.5mol氧气可以得到2mol电子。亚硝酸钠中氮元素的化合价是+3价,其还原产物中氮元素的化合价是+2价,得到1个电子,所以根据电子守恒可知,相当于是节省了2mol亚硝酸钠。
(4)[Fe(OH)]2+离子可部分水解生成[Fe2(OH)4]2+聚合离子,则根据电荷守恒可知一定还有氢离子生成,所以反应的离子方程式为2[Fe(OH)]2++2H2O [Fe2(OH)4]2++2H+。
[Fe2(OH)4]2++2H+。
