用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
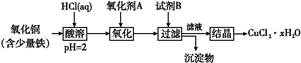
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)。
①Cl2 ②H2O2 ③HNO3 ④KMnO4
(2)要得到较纯的产品,试剂B可选用 。
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)从滤液经过结晶得到氯化铜的方法是 (按实验先后顺序填编号)。
①过滤 ②冷却 ③蒸发浓缩 ④蒸发至干
(4)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体,加入足量10%的氢氧化钠溶液、过滤、洗涤后用小火加热至质量不再减轻为止,冷却、称量所得固体的质量为n g。
①方案一中灼烧CuCl2·xH2O得到无水CuCl2,应在 (填仪器名称)中进行。
方案二中配制一定量10%的氢氧化钠溶液,其操作步骤是计算、称量、 。
②试评价上述两种实验方案,其中可行的方案是 ,另一种方案不可行的理由是 ,若用方案二,计算得x= (用含m、n的代数式表示)。
(1)①② (2)③④ (3)③②① (4)①坩埚 溶解
②方案二 CuCl2·xH2O灼烧时会水解成Cu(OH)2,最后分解成CuO,得不到CuCl2 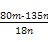
(1)除杂时不能引入杂质。(2)Fe3+水解方程式为Fe3++3H2O Fe(OH)3+3H+,加入铜的化合物,可以与H+反应,促使平衡正向移动,最终生成Fe(OH)3沉淀,过滤即可。不可以加入NaOH、FeO,因为会带入新杂质。(3)含结晶水晶体的获得方法是:蒸发浓缩、冷却结晶。(4)CuCl2·xH2O 加热可以水解,无法获得CuCl2的真实质量。方案二,加入NaOH,可生成Cu(OH)2沉淀,然后加热分解得CuO,依据铜守恒可列式:
Fe(OH)3+3H+,加入铜的化合物,可以与H+反应,促使平衡正向移动,最终生成Fe(OH)3沉淀,过滤即可。不可以加入NaOH、FeO,因为会带入新杂质。(3)含结晶水晶体的获得方法是:蒸发浓缩、冷却结晶。(4)CuCl2·xH2O 加热可以水解,无法获得CuCl2的真实质量。方案二,加入NaOH,可生成Cu(OH)2沉淀,然后加热分解得CuO,依据铜守恒可列式: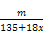 =
=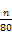 ,由此可解得x值。
,由此可解得x值。
