铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
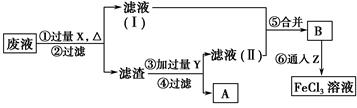
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
(1)O2 粗铜 Cu2+
(2)小于0.9
(3)Fe HCl Cl2 2Fe2++Cl2=2Fe3++2Cl-
用30%的FeCl3溶液腐蚀有铜箔的绝缘板印刷电路板时发生反应:2Fe3++Cu=2Fe2++Cu2+,废液中会含有Fe2+、Cu2+、Fe3+;加入铁粉后,2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+;滤渣中含有过量的Fe和Cu,加入盐酸:Fe+2HCl=FeCl2+H2↑;通入Cl2后,2FeCl2+Cl2=2FeCl3。
