现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为__________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe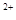 、Cu
、Cu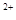 时,则b的取值范围是(用a、x表示)___________。
时,则b的取值范围是(用a、x表示)___________。
(3)当x=0.5,溶液中Fe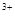 与Fe
与Fe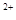 的物质的量相等时,在标准状况下 * * 生672 mL气体。则a=____________、b=_____________。
的物质的量相等时,在标准状况下 * * 生672 mL气体。则a=____________、b=_____________。
(1) Fe2+或Fe2+、Cu2+ (2分)
(2) 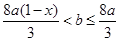 (2分)
(2分)
(3) a=0.04mol b=0.12mol (2分)
题目分析:(1) Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:
①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,溶液可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu恰好与硝酸生成Cu2+,所以溶液中存在的离子是Fe2+、Cu2+;
⑤通过④知,固体没有剩余时,生成的Fe3+部分反应,根据离子共存,溶液中存在的离子可能的Fe2+、Fe3+、Cu2+;
⑥通过④、⑤知,固体没有剩余时,铁、铜全部被氧化成离子,根据离子共存,溶液中存在的离子可能是Cu2+、Fe3+;
有如下情况:
| 残留固体成分 | Fe、Cu | Cu | Cu | -- | -- | __ |
| 溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+、Cu2+ | Fe2+、Cu2+ | Fe2+、Fe3+、Cu2+ | Cu2+、Fe3+ |
(2)当溶液金属离子只有Fe2+、Cu2+时,说明Cu恰好完全反应或者有剩余,而HNO3和Fe则完全反应(否则的话,如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+;如果有Fe剩余,则会和Cu2+继续反应)
3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
ax 
3Fe + 8HNO3 3Fe(NO3)2+2NO↑+ 4H2O
3Fe(NO3)2+2NO↑+ 4H2O
a(1-x) 
总耗用硝酸量:n(HNO3)= +
+ =
=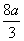
所以: <b≤
<b≤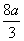
(3)当溶液中为Fe3+、Fe2+时,说明Cu、Fe完全反应(如果未完全反应,则Cu和Fe会和Fe3+反应),并且HNO3也完全反应没有剩余(如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+)溶液中Fe3+、Fe2+的物质的量相等,说明有一半Fe变为Fe3+,一半变为Fe2+
当x=0.5,nFe3+=nFe2+ V(NO)=0.672L
则nFe3+=nFe2+="0.25a" mol nCu = 0.5amol
此时3Fe+8HNO3 3Fe(NO3)2+2NO↑+4H2O ①
3Fe(NO3)2+2NO↑+4H2O ①
3Cu+8HNO3 3 Cu (NO3)2+2NO+4H2O ②
3 Cu (NO3)2+2NO+4H2O ②
3Fe(NO3)2+4HNO3 3Fe(NO3)3+NO+2H2O ③
3Fe(NO3)3+NO+2H2O ③
反应均发生了,且无反应物剩余。
3Fe + 8HNO3 3Fe(NO3)2+2NO↑+4H2O ①
3Fe(NO3)2+2NO↑+4H2O ①
0.5a 0.5a×8/3 0.5a 0.5a×2/3
3Cu+8HNO3  3 Cu (NO3)2+2NO↑+4H2O ②
3 Cu (NO3)2+2NO↑+4H2O ②
0.5a 0.5a×8/3 0.5a 0.5a×2/3
3Fe(NO3)2+4HNO3 3Fe(NO3)3+NO+2H2O ③
3Fe(NO3)3+NO+2H2O ③
0.25a 0.25a ×4/3 0.25a
0.5a×2/3 +0.5a×2/3 + 0.25a×1/3 =0.672L/22.4L·mol-1=0.03mol
解得:a="0.04" mol
b=" 0.5a×8/3" + 0.5a×8/3+0.25a ×4/3="3a=3×0.04" mol ="0.12" mol
