Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化 。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是 。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
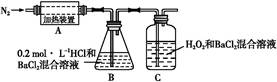
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
Ⅰ.(1)12Fe2++3O2+6H2O=Fe(OH)3↓+8Fe3+(其他合理答案也给分) 铁粉 取少量FeSO4溶液于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。
Ⅱ.(2)硫酸亚铁铵溶液中N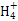 发生水解增大c(H+),抑制了Fe2+氧化反应的进行。
发生水解增大c(H+),抑制了Fe2+氧化反应的进行。
(3)①使分解产生的气体在B、C中被吸收充分
②溶液变浑浊(或出现白色沉淀)
③SO2+H2O2+Ba2+=aSO4↓+2H+(或SO2+H2O2=H++S 、S
、S +Ba2+=aSO4↓)
+Ba2+=aSO4↓)
(1)Fe2+被O2氧化为Fe3+,最终生成红褐色的Fe(OH)3沉淀;加入铁粉可以防止Fe2+被氧化为Fe3+;通常用KSCN检验Fe3+。
(2)N 水解显酸性,c(H+)越大,反应4Fe2++O2+10H2O=Fe(OH)3↓+8H+正向进行的程度越小,Fe2+越不易被氧化。
水解显酸性,c(H+)越大,反应4Fe2++O2+10H2O=Fe(OH)3↓+8H+正向进行的程度越小,Fe2+越不易被氧化。
(3)①通入N2可以将装置中的气体全部排到B和C,保证被完全吸收。
②SO2不和BaCl2反应,但SO3可以和BaCl2反应产生BaSO4沉淀。
③H2O2将SO2氧化为S ,再与Ba2+反应生成BaSO4沉淀。
,再与Ba2+反应生成BaSO4沉淀。
