孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
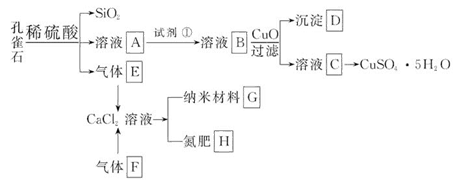
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为_______(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.HNO3
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为______________。加入CuO的作用是_____________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是______________。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) _______ (填化学式)。写出该反应的化学方程式_______________________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用_______ (填写仪器名称);取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为_______。
(1)c Fe(OH)3 调节溶液的pH,促进Fe3+的水解
(2)引流
(3)NH3 2NH3+CO2+H2O+CaCl2=CaCO3↓+2NH4Cl
(4)酸式滴定管(或移液管)
当滴入最后一滴KMnO4溶液时,溶液变成浅紫色且半分钟内颜色不变化
根据题意可分析出该工业流程为:

(1)要除去溶液A中的Fe2+,应把Fe2+氧化为Fe3+,试剂①应为绿色氧化剂H2O2,加CuO的目的是降低H+浓度,使Fe3+水解为Fe(OH)3而除去。
(2)过滤时应用玻璃棒引流。
(3)由气体E为CO2,且和CaCl2溶液和气体F反应生成纳米材料和NH4Cl可知纳米材料G应为CaCO3。气体E为CO2,与CaCl2不反应,应使CaCl2溶液呈碱性才能与CO2反应,由生成NH4Cl可知F气体应是NH3。
(4)KMnO4溶液具有强氧化性,只能用酸式滴定管盛放。KMnO4溶液呈紫红色,当KMnO4过量时显示浅紫色
