问题
填空题
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:
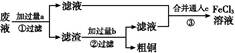
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
答案
Fe+Cu2+=Fe2++Cu ①
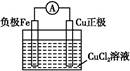
粗铜,Cu-2e-=Cu2+
根据题干信息可知废液应为FeCl3、CuCl2、FeCl2的混合溶液,加入的试剂a为Fe,发生反应为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,经①过滤后,滤渣是Fe与Cu的混合物,再加入过量的b(盐酸)发生反应:Fe+2HCl=FeCl2+H2↑,经②过滤后滤液主要是FeCl2溶液,将合并后的溶液中通入c(Cl2),发生主要反应为:2Fe2++Cl2=2Fe3++2Cl-。Fe+Cu2+=Fe2++Cu可以证明Fe比Cu还原性强,该反应在步骤①中发生。将Fe+Cu2+=Fe2++Cu设计成原电池,Fe作负极,比Fe不活泼的Cu作正极即可,电解质溶液是含Cu2+的溶液。电解精炼铜时,粗铜作阳极,精铜作阴极。
