A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液。
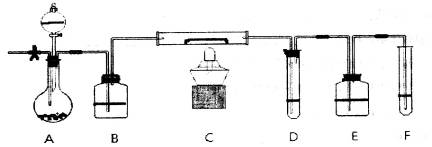
先打开止水夹,通入N2,待装置中空气被赶尽后关诩止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置乖O3)。
(1)淡黄色固体所含化学键的名称为:________;装有遮黄色的固体仪器的名称_______。
(2)如何检查装置的气密性___________________________________________________。
(3)C中反应的化学方程式___________________________________________________。
(4)E装置中反应的离子方程式_______________________________________________。
(5)如F中仍有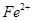 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。
(1)离子键、共价键(2分) 圆底烧瓶(1分)
(2)关闭止水夹,将F中的导管深入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱。(3分)
(3)4HCl + O2 2Cl2 + 2H2O (2分)
2Cl2 + 2H2O (2分)
(4)Cl2 +2OH‾ = Cl‾ + ClO‾ + H2O (2分)
(5)取F中少量溶液于小试管中,滴加一滴KMnO4溶液,KMnO4溶液褪色,说明含有Fe2+(2分)
题目分析:(1)淡黄色固体为Na2O2,含有离子键和共价键。
(2)利用加热气体膨胀的原理进行检验,首先要答上:关闭止水夹,将F中的导管深入水槽中。
(3)C中进入的气体含有HCl、O2,在催化剂存在的条件下加热发生氧化还原反应。
(4)E中发生Cl2与NaOH的反应 。
(5)利用Fe2+具有还原性,能使KMnO4褪色的现象检验。
