某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。
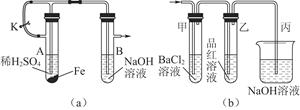
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是
。
②为达到实验目的,正确的操作是 。
B管中发生反应的离子方程式是 。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因
。
②为验证红棕色固体成分,可进行如下操作
。
③图(b)中丙装置的作用是 。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式 。
(1)①A中溶液进入B中,开始产生白色沉淀,然后变为灰绿色,最后变成红褐色
②打开止水夹a,使A管反应一段时间至B中导管有均匀气泡产生后再夹紧止水夹a
Fe2++2OH-=Fe(OH)2↓ (酸与碱的中和反应写或不写均可)
(2)①SO3+H2O=H2SO4
H2SO4+BaCl2=BaSO4↓+2HCl
或SO3+H2O+BaCl2=BaSO4↓+2HCl
②取固体溶于盐酸后,再滴加KSCN溶液,观察到溶液变红色
③吸收SO2
④2FeSO4 Fe2O3+SO3↑+SO2↑
Fe2O3+SO3↑+SO2↑
(1)由装置a看出,实验的原理为先使铁与稀硫酸反应生成H2和FeSO4,打开止水夹K,使生成的H2将装置内空气全部排出后关闭止水夹,H2产生的压力将A管中的FeSO4溶液“压”入B管中,产生Fe(OH)2白色沉淀,处于H2的保护中,能保持较长时间不变色。
(2)试管甲能产生白色沉淀,说明一定产生了SO3,SO2不与BaCl2溶液反应,故乙装置的作用是检验SO2,而丙装置的作用是吸收SO2,防止污染。根据题意,加热FeSO4固体时产生SO2、SO3和Fe2O3,再结合电子守恒可写出反应的化学方程式。
