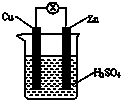
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。
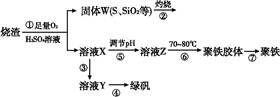
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是 。
A.品红溶液 B.紫色石蕊试液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为 。
(3)过程③中需加入的物质是 。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要 。
(5)过程⑤调节pH可选用下列试剂中的 (填序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是 。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700 0 g样品;②将样品溶于足量的盐酸后,加入过量的BaCl2溶液;③过滤、洗涤、干燥,称重得固体质量为3.495 0 g。若该聚铁的主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)
(1)ACD
(2)4FeS+3O2+6H2SO4 2Fe2(SO4)3+6H2O+4S
2Fe2(SO4)3+6H2O+4S
(3)Fe
(4)蒸发皿、玻璃棒
(5)C
(6)促进Fe3+的水解
(7)31.1%
SO2具有漂白性,能使品红溶液褪色,SO2有还原性,能被酸性KMnO4溶液、溴水氧化,而使它们褪色。溶液X为Fe2(SO4)3,需加入还原剂将Fe3+还原为Fe2+,又不带入杂质离子,故需加入铁粉。过程⑤中需将酸消耗而调高pH,而CaCO3跟硫酸反应会生成微溶于水的CaSO4而阻止反应的继续进行。由聚铁的化学式可知:n(Fe3+)=n(S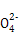 )=
)=
n(BaSO4)=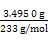 ="0.015" mol,所以聚铁样品中铁元素的质量分数=
="0.015" mol,所以聚铁样品中铁元素的质量分数=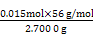 ×100%≈31.1%。
×100%≈31.1%。