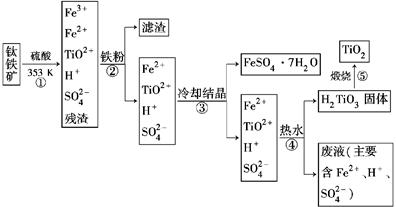
工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________
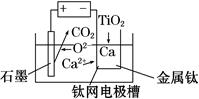
在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
(1)2Fe3++Fe===3Fe2+ (2)b (3)过滤
(4)溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3 (5)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (6)①2O2--4e-=O2↑(或C+2O2--4e-=CO2↑) ②制备Ti时,发生反应:2CaO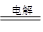 2Ca+O2↑,2Ca+TiO2
2Ca+O2↑,2Ca+TiO2 Ti+2CaO,由此可见,CaO的总量不变(或制备Ti时,阴极发生反应;2Ca2++4e-===2Ca,阳极发生反应:2O2--4e-===O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的总量不变(或制备Ti时,阴极发生反应;2Ca2++4e-===2Ca,阳极发生反应:2O2--4e-===O2↑,2Ca+TiO2 Ti+2CaO,由此可见,CaO的总量不变)
Ti+2CaO,由此可见,CaO的总量不变)
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为2Fe3++Fe=3Fe2+。(2)步骤③中,冷却结晶是利用物质在不同温度下的溶解性差异来实现混合物的分离的。(3)分析流程图可知,步骤②、③、④中均需进行的操作是过滤。(4)步骤③所得溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。(5)废液中主要含有硫酸和硫酸亚铁,与软锰矿反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。(6)①电解槽的阳极发生氧化反应:2O2--4e-=O2↑(或C+2O2--4e-=CO2↑)。②制备金属钛时,发生反应:2CaO 2Ca+O2↑,2Ca+TiO2
2Ca+O2↑,2Ca+TiO2 Ti+2CaO由此可见,CaO的总量不变。
Ti+2CaO由此可见,CaO的总量不变。
