利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下:
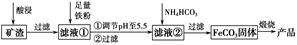
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
(1)Fe3O4+8H+=Fe2++2Fe3++4H2O 合适的酸浓度、连续搅拌、延长酸浸时间等(任答两点即可)
(2)除去滤液①中的Al3+
(3)防止NH4HCO3受热分解或防止Fe2+水解程度增大
(4)4FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
由于矿渣中存在Fe2O3、Fe3O4、FeO、Al2O3、SiO2且后续步骤中加铁粉还原Fe3+,加溶液时只需要用稀盐酸或稀硫酸就可以,不需要用硝酸将铁氧化成Fe3+。
