问题
填空题
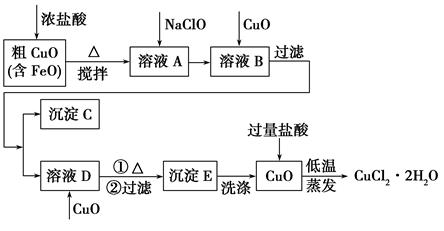
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
(2)沉淀C的化学式为________。
(3)实验室如何检验沉淀E已洗涤干净?________。
(4)低温蒸发的目的是______________________________________。
(5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是________________________________________________。
答案
(1)2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(2)Fe(OH)3
(3)取最后一次洗涤液少量于试管中,加入AgNO3溶液,无白色沉淀生成,说明已洗干净
(4)控制Cu2+水解,防止晶体中结晶水失去(答出一点即可)
(5)一次性加入过量的CuO将导致Fe3+和Cu2+同时生成沉淀
通过对流程的分析,明确工业生产原理,搞清各步操作的意义。其工业生产原理为:将含杂质的粗氧化铜用盐酸溶解,加入氧化剂NaClO将杂质Fe2+氧化为Fe3+,然后再加入适量氧化铜调节溶液pH,使Fe3+转化为Fe(OH)3沉淀通过过滤而除去;然后再向滤液中加入足量氧化铜调节溶液pH并加热,使Cu2+转化为CuO,最后将CuO溶于盐酸,低温蒸发得到氯化铜晶体。
