铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
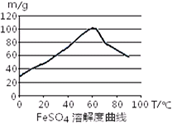
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
A.浓硫酸
B.10moL/L硫酸
C.3moL/L硫酸
D.任意浓度硫酸;温度宜控制在______;加热的同时需适当补充水,原因是 。反应中应保持n(Fe)/n(H2SO4) 1(填“<”、“>”或“=”)。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是 。
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。
(1)倾析
(2)C ; 60℃左右;防止硫酸亚铁晶体析出;>
(3)抑制Fe2+、NH4+的水解
(4)4.4~7.5
(5)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)节约Fe(NO3)3、防止NO污染(同理即可); 3:4
题目分析:
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法。
(2)在室温下,Fe在浓硫酸中会发生钝化现象。在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水。不能得到硫酸亚铁。所以要用3moL/L硫酸。选项为C。由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右。为防止硫酸亚铁晶体析出,加热的同时需适当补充水。为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些。所以反应中应保持n(Fe)/n(H2SO4)>1。
(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。
(4)含有少量Al的废铁屑硫酸溶解得到硫酸铝、硫酸亚铁、硫酸铁。为了除去杂质Al3+、Fe2+.要加NaHCO3时,来调节混合液pH值。Al(OH)3沉淀完全的pH为4.4,而Fe(OH)2开始形成沉淀的pH为应控制在7.5。若把混合液pH值控制在4.4~7.5,就可以使Al(OH)3沉淀完全但Fe元素都留在溶液中。
(5)当向含有FeSO4、Fe2(SO4)3溶液中加入Fe(NO3)3和H2SO4时也就相当于加入了稀硝酸。发生氧化还原反应。在反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
(6)由于在室温下会发生反应:2NO+O2=2NO2;3NO2+H2O =2HNO3+NO。叠加得到总方程式为4NO+3O2+2H2O =4HNO3。所以实际生产中,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染。根据上述总方程式可以看出气体O2与NO配比的比例是3:4。
