铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________;从腐蚀废液回收得到金属铜,还需要的试剂是__________________________。
(3)与明矾相似,硫酸铁也可作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是____________________________
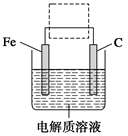
(4)钢铁的电化学腐蚀原理如图所示,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在图中虚线框内作出修改,并用箭头标出电子流动方向。
(1)32
(2)2Fe3++Cu=2Fe2++Cu2+ 铁粉、稀盐酸(稀硫酸)
(3)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
(4)
(1)反应中FeS2中的Fe和S失电子发生氧化反应,O2得电子发生还原反应,8 mol O2得到的电子数为32 mol,即为该反应中转移的电子总数。
(2)回收铜的过程中,Fe3+将Cu氧化为Cu2+,再利用铁将铜置换出来,为除去过量的铁粉可以加入适量稀盐酸或稀硫酸。
(3)Fe3+水解导致溶液呈酸性,在酸性废水中H+抑制了Fe3+的水解。
(4)电化学防护,可以是原电池原理,也可以是电解池原理,故使铁与外加电源的负极相连作阴极即可有效防止钢铁腐蚀。
