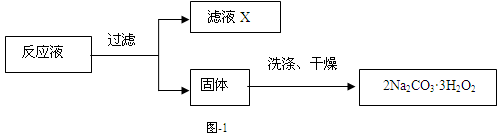
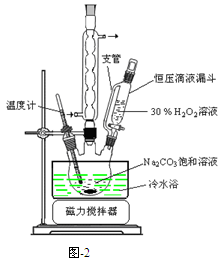
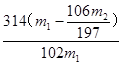过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。
完成下列填空:
(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)不会使过碳酸钠失效的物质是_______(选填编号)。
a.Na2S b.CH3COOH c.NaHCO3
过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数。
(4)完成实验步骤:
溶解 → 沉淀反应 → ________ → ________ → ________ → ________ 。
(5)写出沉淀反应的离子方程式________________________________________。
(6)需要直接测定的物理量有:________________________________(用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为:________________。
(1)使液体顺利流下(1分)
(2)控制反应温度(1分)
(3)C(2分)
(4)过滤、洗涤、干燥、称量(0.5分×4)
(5)Ba2++ CO32-→ BaCO3↓(2分) 或其他正确答案,但必须与42的最后一空答案匹配。
(6)样品的质量m1g、沉淀的质量m2g (1分×2), 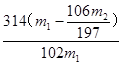 (2分)
(2分)
题目分析:(1)恒压滴液漏斗中支管连接了上下两端使液体上下气压相等,在重力作用下以漏斗中的液体能顺利流下。
(2)由于过氧化氢的稳定性受温度影响大,升温易分解,所以是控制好反应温度是关键。
(3)a.Na2S会和过氢化氢发生氧化还原反应, b.CH3COOH 会和碳酸钠发生反应,只有 c.NaHCO3不会使其变质。
(4)采用重量法最终要测定固体的质量,所以整个实验过程是:溶解 → 沉淀反应 →过滤→洗涤→干燥→称量。
(5)加入了钡离子,最终生成了碳酸钡沉淀,故反应方程为Ba2++ CO32-→ BaCO3↓
(6)要求出过碳酸钠质量分数,需要知道样品的质量m1g和由碳酸钠生成碳酸钡沉淀的质量m2g,这样通过碳元素守恒可得质量分数为: