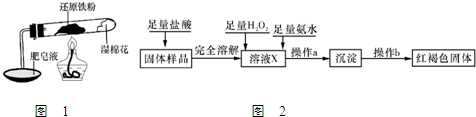
铁不能与冷、热水反应,但能与水蒸气反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.老师用图1所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
(1)实验中使用肥皂液的作用是______.
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
(3 )乙同学设计实验方案如图2以确定实验后试管内的固体是否存在Fe3O4:
①溶液X中发生氧化还原反应的离子方程式为______;足量氨水与金属离子反应的离子方程式为______.
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是______.
③确定是否存在Fe3O4需要测定并记录的实验数据是______.
(1)有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声说明有氢气生成,故答案为:检验反应中生成的H2;
(2)与盐酸反应有气泡冒出说明含有铁;不能确定是否含有Fe3O4或FeO,如果混合物中存在Fe3O4,溶于盐酸生成的 Fe3+与 Fe反应生成了 Fe2+;且溶液中的 Fe2+也有可能是 Fe与 Fe3+反应的产物,故答案为:Fe;Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+;
(3)①Fe2+能被双氧水氧化为Fe3+,反应的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O;Fe3+能与氨水反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:2Fe2++2H++H2O2═2Fe3++2H2O;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
②取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则沉淀已洗干净,
故答案为:取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则沉淀已洗干净;
③固体样品m1克与红棕色固体m2克所含铁元素的物质的量相同,假设全部是FeO,
2FeO≈Fe2O3
144g 160g
m1与m2之比=
=0.9;144g 160g
假设全部是Fe3O4,
2Fe3O4≈3Fe2O3
464g 480g
m1与m2之比=
=0.97,m1与m2之比最少应大于 0.9时,固体样品中一定存在Fe3O4,464g 480g
故答案为:固体样品质量和红褐色固体的质量(其他合理答案也可);
