草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________; 假设二:全部是FeO ; 假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 | 若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:去步骤2得到少量固体与试管中,滴加
|
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
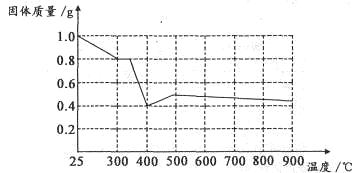
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。
Ⅰ:(1)全部是Fe
(2)
| 实验步骤 | 现象与结论 |
| 步骤1:硫酸铜溶液 | (暗)红色固体 |
| 步骤3:过量HCl,静置,取上层清液,滴加几滴KSCN溶液,再滴加适量新制的氯水 ,充分振荡 | 若滴加适量新制的氯水后溶液呈红色,则证明有FeO |
 FeO+CO↑+CO2↑+2H2O
FeO+CO↑+CO2↑+2H2O 不同意,实验没有在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物
题目分析:
Ⅰ(1)根据物质的组成及后面的假设情况可以推知假设一为固体全部是Fe。(2)步骤一:若固体中含有FeO、Fe.则由于金属Fe是比较活泼的金属,能把活动性比它若的金属置换出来。所以可以向固体混合物中加入硫酸铜溶液,充分振荡后静置,若看到溶液的颜色变浅,同时产生暗红色的固体。就证明含有Fe单质。步骤三:将步骤而所得的的固体加入到足量的稀HCl中,发生反应:FeO+2HCl=FeCl2+H2O.充分振荡后静置,取上层清液,滴加几滴KSCN溶液,无现象,再滴加几滴新制的氯水 ,充分振荡,若看到溶液变为血红色,则证明固体中含有FeO.
II 根据质量守恒定律和电子守恒的规律可知FeC2O4·2H2O晶体受热分解的化学方程式为FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O。根据方程式FeC2O4·2H2O
FeO+CO↑+CO2↑+2H2O。根据方程式FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O可知1g晶体FeC2O4·2H2O分解产生的FeO的质量为0.4g.但由于分解反应在坩埚中敞口充分加热,没有在密闭的容器内进行。FeO有还原性,在加热时容易被空气中的氧气氧化为Fe2O3.所以固体的质量总大于0.4g.因此不能由此得到结论说假设二不成立。3+的检验、方程式的书写的知识。
FeO+CO↑+CO2↑+2H2O可知1g晶体FeC2O4·2H2O分解产生的FeO的质量为0.4g.但由于分解反应在坩埚中敞口充分加热,没有在密闭的容器内进行。FeO有还原性,在加热时容易被空气中的氧气氧化为Fe2O3.所以固体的质量总大于0.4g.因此不能由此得到结论说假设二不成立。3+的检验、方程式的书写的知识。
