(1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g) ,工作原理示意图如下:
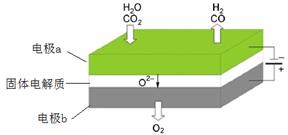
①电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
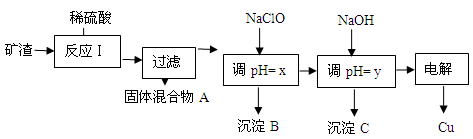
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
(1)① 氧化(2分) ② CO2 + 2e- = CO+O2-(2分)
(2)①SiO2、Cu(各1分) ②Fe2+(2分) 2Fe3+ + Cu = Cu2+ + 2Fe2+(2分)
③5.2≤pH<5.4 (2分) ④ b (2分) ⑤ 5:11 (3分)
题目分析:(1)①根据工作原理示意图可知,电极b上O2‾转化为O2,失去电子发生氧化反应。
②CO2在电极a上得电子,转化为CO和O2‾,电极方程式为:CO2 + 2e- = CO+O2-
(2)①SiO2为不溶于硫酸的难溶物,根据信息:Cu2O + 2H+ =" Cu" + Cu2+ + H2O,所以加入稀硫酸后得到固体混合物含SiO2、Cu
②因为固体混合物中有单质Cu存在,所以Fe元素的存在形式为Fe2+;发生Cu还原Fe3+的反应:2Fe3+ + Cu = Cu2+ + 2Fe2+
③加入NaOH调pH=y的目的是让Al3+转化为Al(OH)3沉淀,所以y对应的数值范围是5.2≤pH<5.4
④a、加入NaClO使溶液的pH升高,错误;b、因为HClO为弱酸,所以加入NaClO后发生反应:ClO-+ H+ HClO,使溶液pH升高,正确;c、NaClO溶液只有少量ClO‾发生水解反应,ClO‾浓度大, NaClO能调节pH的主要原因是发生发生反应:ClO-+ H+
HClO,使溶液pH升高,正确;c、NaClO溶液只有少量ClO‾发生水解反应,ClO‾浓度大, NaClO能调节pH的主要原因是发生发生反应:ClO-+ H+ HClO,错误。
HClO,错误。
⑤设CuSO4•5H2O的质量为x,H2O的质量为y,则160/250x÷(x+y)×100%=20%,可得x:y=5:11。
