 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。

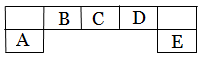
请用化学用语回答下列问题:
 (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D 、E元素简单离子半径由大到小的顺序为_____>______ >______ (填微粒符号 )
 (3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式 ,该阳离子中存在的化学键有 。
 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
(1)第二周期第ⅥA族(1分)
(2)Cl-> O2-> Al3+(2分)
 (3)H2O > H2S(1分)
(3)H2O > H2S(1分)
(4)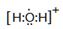 (1分) 极性共价键(1分)
(1分) 极性共价键(1分)
(5)酸性(1分) NH4+ + H2O  NH3·H2O + H+(2分)
NH3·H2O + H+(2分)
 (6)3C(s) + Al2O3(s) + N2 (g) =" 2AlN(s)" + 3CO(g) △H=" +2b" kJ/mol(3分)
(6)3C(s) + Al2O3(s) + N2 (g) =" 2AlN(s)" + 3CO(g) △H=" +2b" kJ/mol(3分)
(7)b、c(2分)
题目分析:根据题意知,A为地壳中含量最高的金属元素,则A为铝元素;结合常见元素在元素周期表中的位置判断:B为碳元素,C为氮元素,D为氧元素,E为氯元素。 (1)D为氧元素,在周期表中的位置:第二周期第ⅥA族;(2)A为铝元素;D为氧元素,E为氯元素;根据微粒半径比较原则判断,简单离子半径由大到小的顺序为Cl-> O2-> Al3+;
(1)D为氧元素,在周期表中的位置:第二周期第ⅥA族;(2)A为铝元素;D为氧元素,E为氯元素;根据微粒半径比较原则判断,简单离子半径由大到小的顺序为Cl-> O2-> Al3+; (3)F与氧同主族且相邻,则F为硫元素,同主族由上到下气态氢化物的稳定性逐渐减弱,其气态氢化物稳定性的大小H2O > H2S;(4)含有10电子的D元素氢化物分子为水分子,用高能射线照射水分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,该阳离子的电子式见答案,该阳离子中存在的化学键有极性共价键;
(3)F与氧同主族且相邻,则F为硫元素,同主族由上到下气态氢化物的稳定性逐渐减弱,其气态氢化物稳定性的大小H2O > H2S;(4)含有10电子的D元素氢化物分子为水分子,用高能射线照射水分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,该阳离子的电子式见答案,该阳离子中存在的化学键有极性共价键; (5)氮元素的简单氢化物与氯元素的最高价氧化物的水化物反应,生成化合物氯化铵,水溶液显酸性,用离子方程式表示其原因NH4+ + H2O
(5)氮元素的简单氢化物与氯元素的最高价氧化物的水化物反应,生成化合物氯化铵,水溶液显酸性,用离子方程式表示其原因NH4+ + H2O  NH3·H2O + H+;(6)
NH3·H2O + H+;(6) 根据题意知,氧化铝、焦炭和氮气在1600 ~ 1750℃生成氮化铝,每生成1 mol 氮化铝,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)该反应的热化学方程式为3C(s) + Al2O3(s) + N2 (g) =" 2AlN(s)" + 3CO(g) △H=" +2b" kJ/mol;(7)在Fe和Cu的混合物中加入一定量硝酸稀溶液,由于铁的还原性比铜强,铁先与硝酸反应,充分反应后,生成硝酸亚铁,还可能有硝酸铜,剩余金属为铜或铁与铜的混合物,m1 g;再向其中加入稀硫酸,发生3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,或3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,a.加入稀硫酸前和加入稀硫酸后的溶液中都不一定有Cu2+,错误;b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+,正确;c.m1一定大于m2,正确;d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中可能有单质铜,错误,选bc。
根据题意知,氧化铝、焦炭和氮气在1600 ~ 1750℃生成氮化铝,每生成1 mol 氮化铝,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)该反应的热化学方程式为3C(s) + Al2O3(s) + N2 (g) =" 2AlN(s)" + 3CO(g) △H=" +2b" kJ/mol;(7)在Fe和Cu的混合物中加入一定量硝酸稀溶液,由于铁的还原性比铜强,铁先与硝酸反应,充分反应后,生成硝酸亚铁,还可能有硝酸铜,剩余金属为铜或铁与铜的混合物,m1 g;再向其中加入稀硫酸,发生3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,或3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,a.加入稀硫酸前和加入稀硫酸后的溶液中都不一定有Cu2+,错误;b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+,正确;c.m1一定大于m2,正确;d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中可能有单质铜,错误,选bc。
