某校化学小组的同学将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备硫酸铜和硫酸铝晶体的方案:
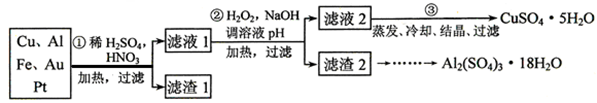
回答下列问题:
(1)第①步参加反应的金属有 种。
(2)第②步加入H2O2是因为滤液1中含有 离子。使用H2O2的优点是 。
(3) 用第③步所得CuSO4·5H2O制备无水硫酸铜的方法是: 。
(4)请帮助化学小组的同学完成由滤渣2制取Al2(SO4)3·18H2O 的实验步骤:
①取滤渣2,加入足量的 ,充分反应后过滤;
②取滤液,加入足量的 (填写试剂的化学式),然后 (填写所需实验操作的名称);
(3)用适量稀硫酸溶解;
(4)最后经过 (填写所需实验操作的名称),获得Al2(SO4)3·18H2O晶体。
(1)第③步所得CuSO4·5H2O含有可溶性杂质Na2SO4。为了用重量法测定CuSO4·5H2O的纯度,选用BaCl2(aq)和其他必要的试剂,请列出必须测定的物理量 。
(1)3 (1分)
(2) Fe2+ (1分); 不引入杂质,还原产物是水,对环境无污染(1分)
(3)控制温度加热或灼烧(1分)
(4)①氢氧化钠溶液(1分) ②二氧化碳或其他弱酸,过滤洗涤(1分×2,没有洗涤扣1分)(4)加热蒸发、冷却结晶、过滤洗涤 (1分×3)
(5)m(试样)、m(恒重后的BaSO4) (1分×2,表述正确给分)
题目分析:39、稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3- Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt; 40、第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染;41、第
3Cu2++2NO↑+4H2O;Au、Pt; 40、第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染;41、第
③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;42、(1)在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费;(2)二氧化碳或其他弱酸,过滤洗涤;(4)最后经过加热蒸发、冷却结晶、过滤洗涤 ,获得Al2(SO4)3·18H2O晶体。 43、必须称量m(试样)和m(恒重后的BaSO4)的质量。