某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:

已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
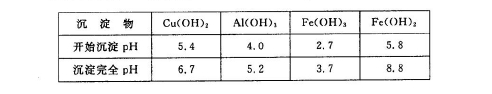
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是 (写2点)。
(2)固体混合物A中的成分是 。
(3)反应I完成后,铁元素的存在形式为 (填离子符号);写出生成该离子的离子方程式 。
(4)操作1主要包括: 、 、 。洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为 .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
(1)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等;
(2)SiO2、Cu
(3)Fe3+ 2Fe3++Cu=Cu2++2Fe2+
(4)蒸发浓缩、冷却结晶、过滤;冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;
(5)0.4mol
(6)2Fe2++7ClO-+2H++5H2O=2Fe(OH)3+Cl-+6HClO
题目分析:(1)由于矿渣为固体,所以为了加快反应I的速率,可以采取的措施是浆固体粉碎。也可以适当升高反应的温度;或增大反应物H2SO4的浓度等措施。(2)SiO2是酸性氧化物,不能与酸发生反应;其它金属氧化物Cu2O、Al2O3、Fe2O3与硫酸发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O;Al2O3+3H2SO4= Al2(SO4)3+3H2O;Fe2O3+3H2SO4= Fe2(SO4)3+3H2O; Fe2(SO4)3+Cu= CuSO4+ 2FeSO4。因此发生反应I后过滤出的固体混合物A中的成分是SiO2、Cu。(3)因为在矿渣中Fe元素的化合价为+3价,先发生复分解反应,得到Fe2(SO4)3,然后发生反应:2Fe3++Cu=Cu2++2Fe2+。因此该完成后,铁元素的存在形式为+2价的Fe。即Fe2+。(4)从硫酸铜溶液中制取硫酸铜晶体的操作1主要包括: 蒸发浓缩、冷却结晶、过滤。洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是CuSO4溶液溶解于水,而且温度越高,溶解度越大。若用冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;(5)用惰性电极电解胆矾溶液电解反应方程式为:2CuSO4+2H2O 2Cu+O2↑+2H2SO4.若加入0.1 mol的Cu(OH)2会发生反应:Cu(OH)2+H2SO4= CuSO4+2H2O 。产生0.1mol的CuSO4和0.2mol的水恢复原来的溶液。则根据电解方程式中的物质间的关系可知电子转移0.4mol。(6)NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO
2Cu+O2↑+2H2SO4.若加入0.1 mol的Cu(OH)2会发生反应:Cu(OH)2+H2SO4= CuSO4+2H2O 。产生0.1mol的CuSO4和0.2mol的水恢复原来的溶液。则根据电解方程式中的物质间的关系可知电子转移0.4mol。(6)NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO
