二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题:
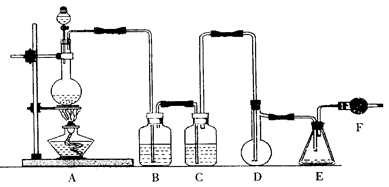
(1)装置A中发生反应的化学方程式为 。
(2)装置B、C应盛放的药品分别是 、 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用的措施是 、如何防止E中液体挥发? 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
(2)饱和食盐水(或水) (1分) 浓硫酸 (1分)
(3)增大反应接触面 (1分)
(4)水浴加热,温度计控制温度 (2分) 将锥形瓶放人冰水中冷却 (1分)
(5)碱石灰(或固态氢氧化钠和生石灰);(1分)防止空气中水蒸气进入E中并吸收残留的氯气。(1分)
(6)SCl2 +SO3 = SOCl2 +SO2 (2分)
题目分析:(1)装置A为制取Cl2的装置,实验室用MnO2与浓盐酸制取Cl2。
(2)制取的氯气中含HCl、H2O杂质,分别用饱和食盐水和浓硫酸除去。
(3)把硫粉变成薄层,可以增大表面积,加快反应速率。
(4)低于100℃的加热一般采用水浴加热,使用温度计能更好的控制反应温度;在冰水中冷却可降低温度,防止生成物的挥发。
(5)尾气中含有未反应的氯气,二氯化硫遇水易分解,所以干燥管内所盛物质能吸收氯气和防止外界空气中的水分进入,故选用碱石灰(或固态氢氧化钠和生石灰)。
(6)根据题目条件可以得出SCl2与SO3为反应物,SOCl2 为产物,根据氧化还原反应规律可得出另一产物为SO2,然后可写出化学方程式。
