实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
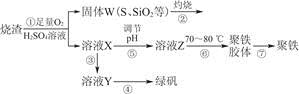
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为______________________________
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三脚架、泥三角,还需要的仪器有________________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是______________________。
(1)ACD
(2)4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S
(3)Fe(或铁) (4)蒸发皿、玻璃棒 (5)B
(6)促进Fe3+的水解
(1)过程②中产生的气体是SO2,具有漂白性(能使品红溶液褪色);SO2对酸碱指示剂没有漂白作用。
(2)FeS化合价升高为1+2=3, O2 化合价降低4,两者个数比是4∶3,再结合原子守恒配平。
(3)过程③中加入铁将Fe3+还原为Fe2+,又不引入杂质。
(4)蒸发溶液时将液体放在蒸发皿中,并不断用玻璃棒搅拌。
(5)中和过量硫酸,选择CaCO3固体,若选择NaOH 溶液,则易使Fe3+沉淀。
(6)升高温度,促进Fe3+的水解。
