一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2: 。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为 。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。
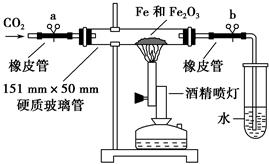
①按如图装置连接好仪器(暂不装入药品), 。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹, ,即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
(5)实验结论:铁与氧化铁反应的化学方程式为 。
(1)产物为Fe3O4
(2)Fe与Fe2O3反应的产物为Fe3O4(表述合理即可)
(3)①夹上弹簧夹a,松开弹簧夹b,微热玻璃管,若导管口有气泡冒出,停止加热一段时间后,导管中形成一段水柱,则装置不漏气 ③通入纯净干燥的二氧化碳气体,待玻璃管里的空气被排完了
(4)
| 实验步骤 | 预期现象和结论 |
| 步骤1:用磁铁靠近黑色粉末 | 黑色粉末在空气中不变色,且能被磁铁全部吸引,说明黑色粉末中没有FeO |
| 步骤2:取少量黑色粉末,放入试管中,加入稀盐酸,振荡使粉末溶解,然后滴入几滴KSCN溶液 | 有气泡冒出,溶液变红色,说明铁粉过量,生成物为Fe3O4 |
 3Fe3O4
3Fe3O4实验要在无氧环境中进行。检验Fe3O4时,一是要利用它的磁性排除Fe2O3、FeO的干扰,二是要检验+3价铁离子的存在,排除铁的干扰。
