黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
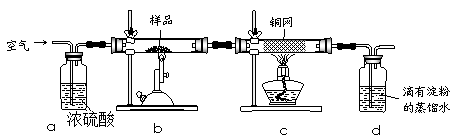
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为 (填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是 和 (填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
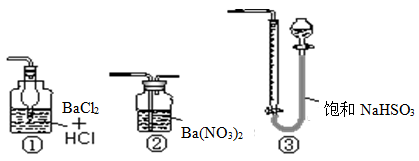
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有 。
(1)电子天平,使原料充分反应、加快反应速率。
(2)b、d和e
(3)使反应生成的SO2全部进入d装置中,使结果精确。
(4)80%
(5)②。
(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4
(1)托盘天平的精确度为 0.1g,故只有电子天平才能称取1.150g样品;研细的目的是增大固体的表面积,使原料充分反应、加快反应速率;
(2)浓硫酸能除去空气中的水蒸气,且洗气瓶有利于观察空气流速;灼热铜网的目的是除去反应后多余的氧气;
(3)反应结束后,装置中还有SO2,所以仍需通入一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确;
(4)由c•V可知n(I2)=0.05mol/L×20.00×10-3L,由I2+SO2+2H2O=4H++2I-+SO42-可知n(SO2)=n(I2)=0.05mol/L×20.00×10-3L,则总的n(SO2)=0.05mol/L×20.00×10-3L÷1/10,由CuFeS2~2SO2可知,n(CuFeS2)=0.05mol/L×20.00×10-3L÷1/10÷2,由n•M可知m(CuFeS2)=0.05mol/L×20.00×10-3L÷1/10÷2×184g/mol,则其纯度为0.05mol/L×20.00×10-3L÷1/10÷2×184g/mol÷1.150g×100%=80%;
(5)SO2不能与BaCl2反应,故①错误;SO2与Ba(NO3)2溶液反应,生成白色的硫酸钡沉淀,过滤、干燥、称取沉淀的质量,可以测定样品的纯度,故②正确;SO2不能与NaHSO3溶液反应,故③错误;
(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4,这些因素都可能导致误差