从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
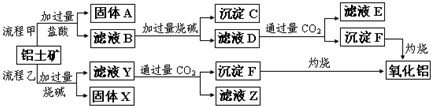
请回答下列问题:
(1)Fe的原子序数为26,Fe位于元素周期表中第______周期,第______族.
(2)流程甲加入盐酸后生成Al3+的离子方程式为______;流程乙加入烧碱后生成SiO32-的离子方程式为______.
(3)滤液E中溶质的主要成份是______(填化学式),写出该溶液的一种用途:______.
(4)写出检验滤液B中是否含Fe3+离子的方法:______.
(1)26-2(第1周期元素种类)-8(第2周期元素种类)-8(第3周期元素种类)=8<18(第4周期元素种类),所以Fe位于元素周期表中第四周期,第 VIII族,
故答案为:四;VIII;
(2)Al2O3与盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+═2Al3++3H2O;
SiO2与氢氧化钠反应生成硅酸钠和水,离子方程式为SiO2+2OH-═SiO32-+H2O.
故答案为:Al2O3+6H+═2Al3++3H2O;SiO2+2OH-═SiO32-+H2O;
(3)根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO3;制纯碱或做发酵粉等;
(4)Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:取少量滤液B于试管中,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+.