亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案: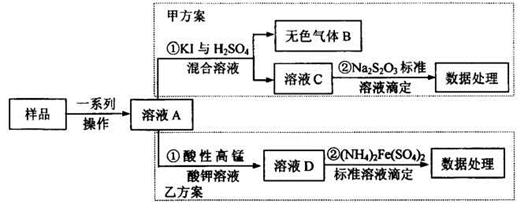
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+ NO2-+ = Mn2++ NO3-+ ,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.
(14分)
(1)NO (1分), 2I- +2NO2-+4H+ =I2+ 2NO↑+2H2O(2分)
(2)2MnO4-+ 5NO2-+ 6 H+ =" 2" Mn2+ + 5NO3-+ 3H2O (2分)
(3)玻璃棒、100mL容量瓶、胶头滴管,3分)
向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加
蒸馏水至液面与刻度线相切。(3分)
(4)690/a (3分)
题目分析:工艺流程的解题的关键,搞清楚加入了什么物质,发生什么反应(氧化还原反应居多),如何分离等。方案甲和乙分别为氧化还原反应,甲方案用到亚硝酸根的氧化性,方案乙用到亚硝酸根的还原性,两方程式分别为,甲:2I- +2NO2-+4H+ =I2+ 2NO↑+2H2O;乙:2MnO4-+ 5NO2-+ 6 H+ =" 2" Mn2+ + 5NO3-+ 3H2O;然后甲用Na2S2O3滴定I2,乙用(NH4)2Fe(SO4)2滴定过量高锰酸钾;根据滴定的量可以计算。(4)5Fe2+~MnO4-;n(MnO4-)=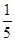 ×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=
×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=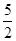 ×4×10-6mol=10-5mol,故每kg中含有690/amg。
×4×10-6mol=10-5mol,故每kg中含有690/amg。
