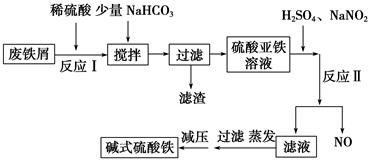
(14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作__________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)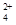 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。
Fe(OH)3的Ksp=____________。(提示,开始沉淀c(Fe3+)浓度为1.0×10-5mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO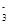 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
(1)①4.4~7.5 ②H++HCO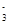 ===CO2↑+H2O,Al3++3HCO===Al(OH)3↓+3CO2↑
===CO2↑+H2O,Al3++3HCO===Al(OH)3↓+3CO2↑
(2)氧化剂 2 mol
(3)2Fe(OH)2++2H2O Fe2(OH)
Fe2(OH)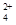 +2H+;10-37.4
+2H+;10-37.4
(4)酸性KMnO4溶液或铁氰化钾。
题目分析:(1)根据工艺流程可知加NaHCO3除去Al3+保留Fe2+,因而要控制pH使Al3+完全沉淀,而Fe2+不沉淀。(2)反应Ⅱ中通入的O2与NaNO2均作氧化剂,根据得失电子守恒,可以计算出标准状况下11.2 L O2与2 mol NaNO2得到的电子数相等。(3)依据原子守恒及电荷守恒可以写出Fe(OH)2+水解生成Fe2(OH)的离子方程式:2Fe(OH)2++2H2O Fe2(OH)
Fe2(OH)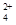 +2H+。pH=3.2时完全沉淀,c(H+)=10-3.2mol/L,c(OH-)=10-10.8mol/L,Ksp=c(Fe3+)·c3(OH-)=10-5×(10-10.8)3=10-37.4。(4)因产品中含Fe3+,可以用酸性KMnO4溶液检验Fe2+的存在,如含有Fe2+,则滴入几滴酸性KMnO4溶液后,溶液的紫色会褪去,否则不褪色。也可用铁氰化钾,溶液出现蓝色沉淀含有Fe2+,否则不产生蓝色沉淀
+2H+。pH=3.2时完全沉淀,c(H+)=10-3.2mol/L,c(OH-)=10-10.8mol/L,Ksp=c(Fe3+)·c3(OH-)=10-5×(10-10.8)3=10-37.4。(4)因产品中含Fe3+,可以用酸性KMnO4溶液检验Fe2+的存在,如含有Fe2+,则滴入几滴酸性KMnO4溶液后,溶液的紫色会褪去,否则不褪色。也可用铁氰化钾,溶液出现蓝色沉淀含有Fe2+,否则不产生蓝色沉淀
