.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
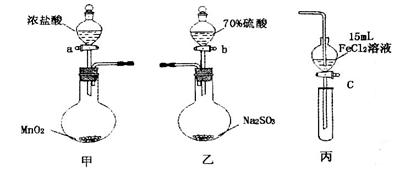
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
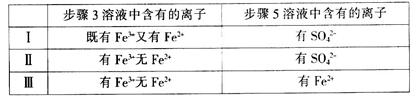
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
33.答案(16分)
(1)MnO2 + 4 HCl(浓)= MnCl2 + Cl2↑+ 2H2O (加热)(2分)(不写“加热”、“浓”不得分;不标气体符号扣1分)
(2)70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快 (2分)(只答“70%的H2SO4溶液溶液中H+浓度大”也可得分)
(3)2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO32- + 4H+(2分)
(4)Ⅰ和Ⅲ (4分;各2分)
(5)①FeI2、KSCN、CCl4(3分)
③下层(CCl4层)先由无色变为紫红色(1分);后看到上层溶液由浅绿色(1分)变为红色(1分)。
题目分析: (1)根据甲装置中的物质提示,可以判断该装置是实验室制备氯气的发生装置,所以该装置中发生的反应是MnO2 + 4 HCl(浓)= MnCl2 + Cl2↑+ 2H2O。
(2)装置乙是实验室制备SO2的发生装置,该反应的原理是利用难挥发的酸性强的硫酸制备酸性较弱且易分解的亚硫酸,所以要较快制得较多的亚硫酸(SO2)则需要溶液中含有的氢离子的浓度较大,所以对于不同浓度的硫酸而言,硫酸的浓度小,电离程度越大,所以用70%的硫酸制取SO2,溶液中H+浓度大,反应速率比用98%的硫酸快。
(3)得以证明氧化性Fe3+>SO2 ,则在变黄的氯化亚铁中通入SO2后,SO2又被Fe3+ 氧化,所以反应的离子方程式为2Fe3+ + SO2 + 2H2O =" 2" Fe3+ + SO32- + 4H+ 。
(4)I组同学检验得到的步骤3溶液既含有Fe3+又含有Fe2+ ,说明溶液中的Fe3+ 是氯气氧化而得,且一定不含有过量的氯气,所以步骤5中检测到的SO42- ,也一定是由Fe3+ 氧化SO2所得,因此可以得出结论氧化性:Cl2>Fe3+>SO2 。III组同学检测到的步骤3溶液只有Fe3+不含Fe2+,能说明溶液中的Fe3+ 是氯气氧化而得,而步骤5中检测到的Fe2+,也可以说明溶液中Fe2+ 是SO2还原Fe3+ 而得,所以可以得出氧化性:Cl2>Fe3+>SO2 的结论。II组同学检测到的步骤3溶液只有Fe3+不含Fe2+,与III组同学相似,溶液中都有可能溶解有过量的氯气,因此步骤5中检测到的SO42- ,有可能是溶解在其中的过量氯气氧化SO2所得,所以不能说明氧化性Fe3+>SO2 ,因此选I、III。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则必须要在分液漏斗中加入含有Fe2+ 、I-的试剂,所以可以选用FeI2 盐溶液;证明氧化生成了Fe3+和 I2 则需要加入检验性的试剂KSCN和有机溶剂如CCl4。若观察分层的溶液的上层浅绿色变红,下层显紫红色,则结论正确。
