混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此判断:
(1)固体B所含物质的化学式为______.
(2)固体E所含物质的化学式为______.
(3)反应①的离子方程式为______.
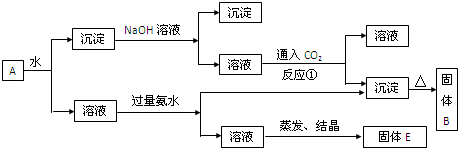
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
(1)、向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和碳酸钠(或者碳酸氢钠,取决于CO2的量),Al(OH)3受热分解2Al(OH)3
Al2O3+3H2O,生成Al2O3; △ .
故答案为:Al2O3
(2)、向溶液中加过量氨水,溶液与过量氨水反应,Al3++3NH3.H2O=3NH4++Al(OH)3↓,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4.
故答案为:K2SO4;(NH4)2SO4
(3)、向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和Na2CO3(或者NaHCO3,取决于CO2的量)
反应①CO2不足时,生成Al(OH)3沉淀和碳酸钠,离子方程式为:2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓;
CO2过量时,生成Al(OH)3沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
故答案为:2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓或AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
