铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
[规格]每片含琥珀酸亚铁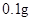 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 小儿用量预防量 [贮藏]避光、密封、在干燥处保存。 |
(1)该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用。
①实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应)。请写出该反应的离子方程式: 。
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
③某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)

(2)称量上述含铁元素质量分数为20.00%的“速力菲”10.00 g,将其全部溶于稀H2SO4中,配制成1000 ml溶液,取出20.00 ml,用0.01000 mol•L-1的KMnO4溶液滴定,用去KMnO4溶液12.00 ml ,该药品中Fe2+的氧化率为 。
(3)已知琥珀酸为二元有机羧酸,含23.6 g琥珀酸的溶液与4.0 mol•L-1 100.0 ml的氢氧化钠溶液恰好完全中和。核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。
(1)①5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O(2分) ②250ml容量瓶(2分)③b(2分)
(2)16.00% (3分)
(3)HOOC-CH2CH2-COOH+2NaOH→NaOOC-CH2CH2-COONa+2H2O (3分)
题目分析:(1)①Fe2+具有还原性,倍氧化会生成成Fe3+,高锰酸钾溶液具有强氧化性,能氧化亚铁离子,其中MnO4-中Mn的化合价由+7价降为+2价,变化5,Fe2+中Fe由+2价升为+3价,变化1,根据化合价升降总数相等和质量守恒得反应的离子方程式为5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O。
②要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需250ml容量瓶。
③a、高锰酸钾溶液具有强氧化性,能腐蚀碱式滴定管的橡皮管,故a错误;b、高锰酸钾溶液具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,故b正确;c、硫酸亚铁溶液显酸性,应该放在酸式滴定管中,同时滴定终点颜色由深变浅深不易于观察,故c错误,答案选b。
(2)由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01 mol/L×12.00×10-3L×5×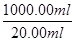 =0.03 mol,m(Fe2+)=0.03 mol×56 g/mol=1.68 g,所以Fe2+的氧化率=
=0.03 mol,m(Fe2+)=0.03 mol×56 g/mol=1.68 g,所以Fe2+的氧化率= =16.00%。
=16.00%。
(3)消耗氢氧化钠的物质的量是0.4mol,当琥珀酸为一元酸时,根据与碱反应的关系,其相对分子质量为23.6÷0.4=59,不符合有机物组成原则;当琥珀酸为二元酸时,其相对分子质量为23.6÷0.2=118,又琥珀酸分子中有两种位置不同的氢原子,所以琥珀酸的结构简式为HOOC-CH2-CH2-COOH,因此琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式为HOOC-CH2CH2-COOH+2NaOH→NaOOC-CH2CH2-COONa+2H2O。

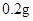 —
—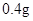 /日。
/日。 —
— /日,治疗量
/日,治疗量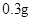 /日
/日