CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
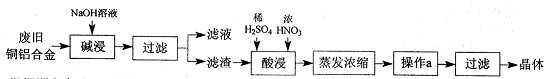
根据题意完成下列填空:
(1)“碱浸”的目的是 ,写出有关的离子方程式 。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有 。
(3)操作a的名称为 ,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为 。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为 ;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式 。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点 。
(1)溶解金属铝、除去油污 2Al+2H2O+2OH-=2AlO2-+3H2↑
(2)金属溶解,溶液变蓝,有无色气体产生且在溶液上方变为红棕色
(3)冷却结晶 重结晶
(4)0.92 用标准盐酸润洗2~3次
(5)Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
题目分析:(1)实验目的是利用废旧铝铜合金制备硫酸铜晶体,故应先除杂。碱浸即是除杂过程,除去表面的油污和溶解金属铝,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;(2)加入少量浓硝酸后稀释,与铜反应,生成硫酸铜和NO气体,故现象为铜溶解,溶液变为蓝色,有无色气体产生并只溶液上方变为红棕色(变成NO2);(3)采用冷却结晶的方法分理出硫酸铜晶体,除去晶体中的可溶性杂质的方法是重结晶;
(4)与CuSO4的氢氧化钠的量n(NaOH)=28.00×0.1000×10-3-8.00×0.1000×10-3=2×10-3mol
n(CuSO4·5H2O) = n(NaOH)/2=10-3mol w(CuSO4·5H2O)=10-3×250÷0.26=0.92
(5)过氧化氢是一种绿色氧化剂,相对浓硝酸而言不产生污染性气体,不产生杂质
