某试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图进行实验:
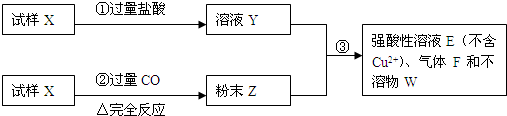
(1)请写出步骤①中发生的全部反应的离子方程式______
(2)请写出步骤③中发生的全部反应的离子方程式______.
(3)若全部的溶液Y和全部的粉末Z充分反应生成不溶物W的质量为32g,气体F在标准状况下体积为5.6L,所得溶液的体积为200mL,则每份试样X的质量______g,所得溶液E中Fe2+的物质的量浓度为______mol/L.
(1)金属氧化物和酸反应生成盐和水,金属氧化物、若电解质写化学式,强电解质写离子式,所以氧化亚铁和盐酸、氧化铜和盐酸反应的离子方程式分别为:FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
所以溶液Y为氯化亚铁和氯化铜的混合溶液.
故答案为:FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
(2)因为CuO+CO
Cu+CO2,FeO+CO △ .
Fe+CO2 ,所以固体粉末Z为Cu和Fe.铁能和铜离子发生置换反应,所以铁和铜离子发生的离子方程式为:Fe+Cu2+=Cu+Fe2+; △ .
强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应铁过量,铁还和酸反应,所以铁和酸反应的离子方程式为:Fe+2H+=Fe2++H2↑;
故答案为:Fe+Cu2+=Cu+Fe2+;Fe+2H+=Fe2++H2↑.
(3)溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以以W的一半计算试样中的氧化铜的质量;
CuO--Cu
80g 64g
20g 16g
所以试样中氧化铜的质量为20g;
粉末Z中的铁单质,一部分和铜离子发生置换反应,一部分和酸发生置换反应,根据粉末Z中的铁单质计算试样中的氧化亚铁的质量.
Fe+Cu2+=Cu+Fe2+;
56g 64g
14g 16g
所以和铜离子发生置换反应的铁为14g;
Fe+2H+=Fe2++H2↑
56 22.4L
14g 5.6L
所以与酸反应的铁的质量是14g;
即粉末Z中铁的质量为14g+14g=28g;
FeO--Fe
72g 56g
36g 28g
所以试样中含FeO 36g;
所以试样的质量为20g+36g=56g
最终两份试样中的氧化亚铁全部转化为Fe2+,两份试样中氧化亚铁的质量为36g×2=72g.
FeO--Fe2+
72g 1mol
72g 1mol
所以Fe2+的物质的量为1mol,C(Fe2+)=
=n V
=5mol/L1mol 0.2L
故答案为:56g;5mol/L.
