铁元素及其化合物与人类的生产生活息息相关,
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式______.
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g).
已知:Fe(s)+
O2(g)═FeO(s)△H=-272kJ•mol-11 2
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ•mol-1
则:①FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H=______.
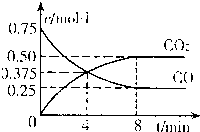
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=______;该温 度下,FeO(s)+CO(g)⇌Fe(s)+CO2(g)的化学平衡常数K=______.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______.
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)①a、Fe(s)+
O2(g)═FeO(s)△H=-272kJ•mol-11 2
b、C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
c、2C(s)+O2(g)═2CO(g)△H=-22lkJ•mol-1
依据盖斯定律b-c÷2-a得到:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H=-1lkJ•mol-1;
故答案为:一1lkJ•mol-1;
②阳极图象分析,从开始至达到平衡过程中CO的浓度变化为0.75mol/L-0.25mol/L=0.5mol/L;时间为8min,所以v=
=0.625mol•L-1•min-1;0.5mol/L 8min
FeO(s)+CO(g)⇌Fe(s)+CO2(g)平衡状态物质的浓度为:c(CO)=0.25mol/L,c(CO2)=0.5mol/L,K=
=c(CO2) c(CO)
=2;0.5mol/L 0.25mol/L
故答案为:0.625mol•L-1•min-1;2;
(3)氢气的物质的量为
=0.1mol,2.24L 22.4L/mol
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为
×(0.16L×5mol/L-0.2mol)=0.2mol,1 3
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
