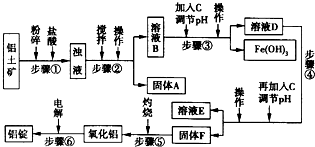
生活中常使用的铝合金中的铝来自于电解熔融氧化铝.用于工业电解的氧化铝要求其纯度不得低于98.2%,而天然铝土矿中的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下所示:
一些难溶物开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol、L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______.
(1)氧化铝和盐酸反应生成氯化铝和水,离子反应方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)分离液态和不溶性固体采用过滤的方法,故答案为:过滤;
(3)二氧化硅和盐酸不反应,所以A固体物质是SiO2,步骤③中加入的物质C中和盐酸,且除去铁离子,应该碱,一般常用NaOH 或Ca(OH)2溶液,步骤④中调节溶液pH,使铝离子完全沉淀,而其它离子不沉淀,所以溶液中的Na+、Ca2+、Mg2+是在步骤④中除去的,
故答案为:SiO2;NaOH 或Ca(OH)2;④;
(4)根据表格知,步骤③中要完全除去铁离子,溶液的pH=4.1,pH=4时铝离子开始沉淀,pH=5.2时铝离子完全沉淀,所以要完全除去铁离子,溶液的4.1<pH<4.5;
步骤④中要使铝离子完全沉淀,溶液的pH=5.2,亚铁离子开始沉淀溶液的pH=10.4,所以要使铝离子沉淀完全而亚铁离子不产生沉淀,则溶液的5.2<pH<10.4,
故答案为:4.1<pH<4.5;5.2<pH<10.4;
(5)工业上采用电解氧化铝的方法冶炼铝,反应方程式为:2Al2O3
4Al+3O2↑,故答案为:2Al2O3 电解 . 冰晶石
4Al+3O2↑. 电解 . 冰晶石
