现有含FeCl2杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
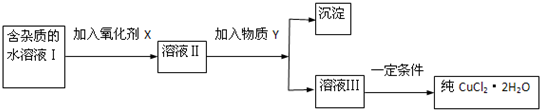
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH如下表.
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
(1)本实验最适合的氧化剂X是______(填序号).
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加氧化剂的目的是______.
(3)物质Y是______(写化学式),加入Y的目的是______.
(4)除去Fe3+的有关离子方程式是______.
(5)加入物质Y后得到的沉淀是______(写化学式).如何洗涤该沉淀沉淀?______.
(6)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?______,应如何操作?______.
(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故答案为:C;
(2)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,故答案为:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离;
(3)结合题示,调节pH3.2~4.7,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3;调节溶液的pH至3.2~4.7;
(4)除去Fe3+的有关离子方程式Fe3++3H2O⇌Fe(OH)3+3H+,CuO+2H+═Cu2++H2O,故答案为:Fe3++3H2O⇌Fe(OH)3+3H+,CuO+2H+═Cu2++H2O[或Cu(OH)2+2H+═Cu2++2H2O等];
(5)溶液Ⅱ为三价铁离子,Y为Fe(OH)3;Fe(OH)3可用蒸馏水洗涤,故答案为:Fe(OH)3;加蒸馏水至刚好淹没沉淀,过滤,重复几次;
(6)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl气氛中采用低温减压蒸发结晶的方法,以得到CuCl2•2H2O的晶体,故答案为:不能;应在HCl的气流中加热蒸发.

