铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是_____________________
(2)某实验小组利用下图装置验证铁与水蒸气的反应。
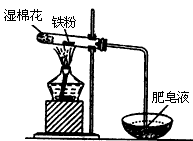
①湿棉花的作用是____________,试管中反应的化学方程式是________________。
②实验结束后,取出少量反应后的同体于试管中,加入过量盐酸,同体完全溶解,所得溶液中存在阳离子是____(填序号)。
a.一定有Fe2+、H+和Fe3+
b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有H+
d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、
CO2和H2。
①铁与浓硫酸反应的化学方程式是_________________
②气体中混有CO2的原因是(用化学方程式表示)_________________
③将672 mL(标准状况)收集到的气体通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4. 66 g,由此推知收集到的气体中SO2的体积分数是____。
(1)浓硫酸具有强氧化性,在铁表面生成一层致密的氧化膜
(2)①提供水蒸气;3Fe+4H2O(g) Fe3O4+4H2;②b
Fe3O4+4H2;②b
(3)①2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O;②C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;②C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;③66.7%
CO2↑+2SO2↑+2H2O;③66.7%
