在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应.某同学利用铁与水蒸气反应后的固体物质进行了如图实验:
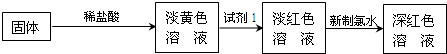
(1)铁粉与水蒸气反应的化学方程式是:______.
(2)证明还原铁粉与水蒸气发生了反应的方法是______.
(3)固体溶于稀盐酸的化学方程式为______.
(4)试剂1的化学式是______.
(5)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)______;
(6)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究.
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:______;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是______.
(1)固体加入稀盐酸得到溶液为淡黄色,说明可能含有三价铁离子,加入硫氰酸钾溶液变红进一步证明含三价铁离子,加入氯水红色加深说明溶液中含有亚铁离子被氧化,生成的硫氰酸铁浓度增大红色加深,证明溶解的溶液中含有二价铁离子,铁和水蒸气反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2 故答案为:3Fe+4H2O(g) △ .
Fe3O4+4H2 △ .
(2)证明还原铁粉与水蒸气发生了反应的方法是收集气体进行爆鸣实验,证明铁发生了反应,
故答案为:检验是否有H2产生;
(3)四氧化三铁含有二价铁和三价铁和盐酸发生反应的化学方程式为:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O,
故答案为:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O;
(4)试剂1加入后淡黄色溶液变为血红色,证明加入稀盐酸反应生成的溶液中含有三价铁离子,检验三价铁离子形成血红色溶液的试剂为硫氰酸钾溶液或硫氰酸按溶液等;所以化学式为KSCN或NH4SCN;
(5)加入新制氯水后溶液红色加深,说明二价铁离子被氯气氧化为三价铁离子形成 的硫氰酸铁浓度增大,溶液血红色加深,所以发生的氧化还原反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(6)①血红色溶液是硫氰酸铁的络合物,在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,证明硫氰酸铁的络合物不存在,可能是三件铁离子不存在或硫氰酸根不存在,都有可能被加入的氯气强氧化剂氧化,所以根据题意,假设2为SCN-被过量的氯水氧化,
故答案为:SCN-被过量的氯水氧化;
②实验方案的依据是证明三价铁离子的存在,所以在褪色的溶液中加入过量的硫氰酸钾溶液,若出现血红色,证明假设2正确,否则假设2不正确;
故答案为:取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确;
